Veligheidsprofiel
Primaire veiligheidsresultaten
In de AcT fase 3 studie werd geen verschil in veiligheidsprofiel waargenomen tussen tenecteplase en alteplase bij de behandeling van AIS.†1
In de AcT studie was het risico van belangrijke ongewenste voorvallen, waaronder overlijden binnen 90 dagen en symptomatische intracerebrale bloeding, vergelijkbaar voor tenecteplase vergeleken met alteplase. Tenecteplase was ook vergelijkbaar met alteplase wat betreft het percentage andere veiligheidseindpunten, waaronder hemorragisch infarct en intracraniële, subarachnoïdale en intraventriculaire bloeding.1
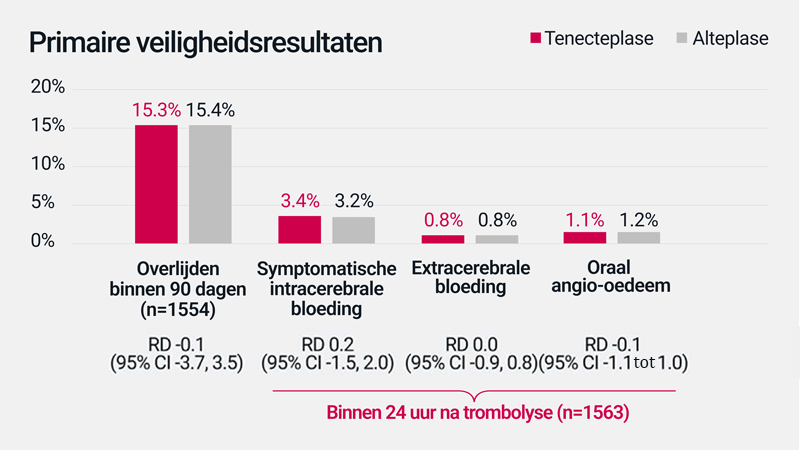
Deze figuur is geproduceerd door Boehringer lngelheim op basis van ref. Menon BK, et al. Lancet 2022; 400:161- 169.
De AcT fase 3 studie is een multicentrische, open-label, parallelle groep, register-gekoppelde RCT waarin 1600 patiënten werden gerekruteerd uit 22 primaire of gespecialiseerde beroertecentra in Canada. Patiënten kwamen in aanmerking voor deelname als ze 18 jaar of ouder waren, met een diagnose van ischemische beroerte resulterend in invaliderende neurologische uitval, die zich presenteerden binnen 4,5 uur na het optreden van de symptomen en volgens de Canadese richtlijnen in aanmerking kwamen voor trombolyse. Deelnemers werden 1:1 gerandomiseerd en behandeld met tenecteplase (0,25 mg/kg, tot een maximum van 25 mg; n=8I6) of alteplase (0,9 mg/kg, tot een maximum van 90 mg; n=784). De primaire uitkomst was een mRS-score van 0-1, genomen 90-120 dagen na behandeling, beoordeeld in een geblindeerde ITT-populatie.1
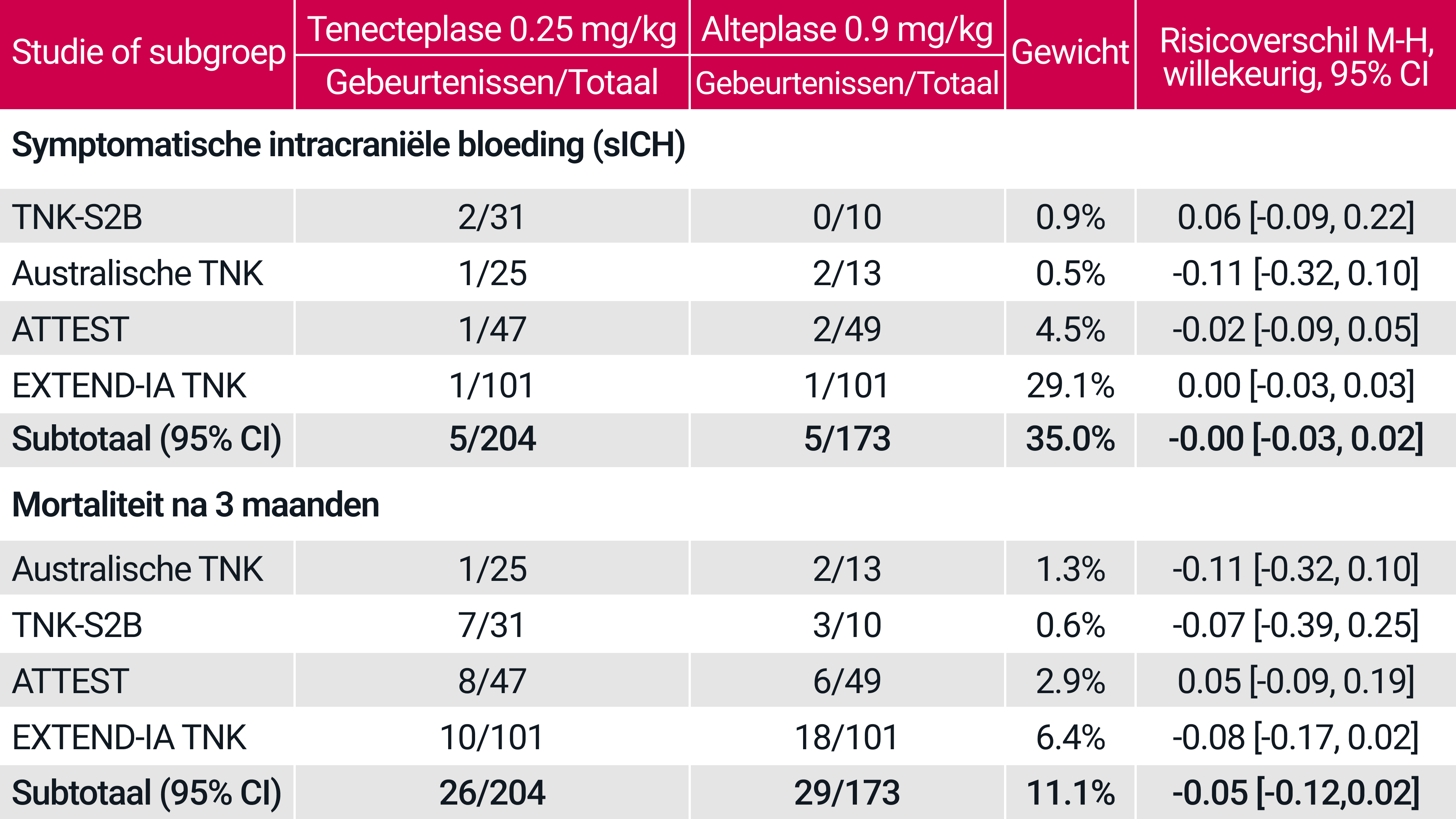
Deze tabel is opgesteld door Boehringer Ingelheim op basis van ref. Buigos A. M. and Saver J. L. Stroke 2019; 50:2156-2162 (Supplement) Nor-Test is niet opgenomen omdat deze alleen Tenecteplase 0,4 mg testte.
Een meta-analyse van 5 RCT's liet ook vergelijkbare veiligheidsresultaten zien voor tenecteplase t.o.v. alteplase bij de behandeling van AIS.‡2
Een systematisch literatuuronderzoek en een meta-analyse werden uitgevoerd volgens de PRISMA-richtlijnen, aangepast voor non-inferioriteitsanalyse. De primaire uitkomst was afwezigheid van invaliditeit (mRS score, 0-1) na 3 maanden, en additionele werkzaamheids- en veiligheidsuitkomsten werden geanalyseerd. Het systematische literatuuronderzoek identificeerde 5 onderzoeken waarbij in totaal 1.585 patiënten waren betrokken (tenecteplase = 828 en alteplase 757). Patiënten die alteplase kregen, ontvingen de standaarddosis van 0,9 mg/kg, terwijl de dosis tenecteplase varieerde van 0,1 mg/kg in 6,8%, 0,25 mg/kg in 24,6% en 0,4 mg/kg in 68,6% van de deelnemers.2
Frequentie bijwerkingen
| Systeem/orgaanklasse | Bijwerking |
| Immuunsysteemaandoeningen | |
| Zelden | Anafylactische reactie (inclusief rash, urticaria, bronchospasmen, larynxoedeem) |
| Zenuwstelselaandoeningen | |
| Zeer vaak | Intracraniële bloeding (zoals cerebrale bloeding, cerebraal hematoom, hemorragische beroerte, hemorragische transformatie ten gevolge van een beroerte, intracraniaal hematoom, subarachnoïdale bloeding) inclusief verwante symptomen als somnolentie, afasie, hemiparese, convulsie |
| Oogaandoeningen | |
| Soms | Oogbloeding |
| Hartaandoeningen | |
| Zelden | Pericardhemorragie |
| Bloedvataandoeningen | |
| Zeer vaak | Bloedingen |
Zelden | Embolie (trombo-embolie) |
| Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |
| Vaak | Bloedneus |
Zelden | Longbloeding |
Maagdarmstelselaandoeningen | |
| Vaak | Gastro-intestinale bloeding (zoals maagbloeding, maagulcusbloeding, rectale bloeding, bloedbraken, melaena, mondbloeding) |
Soms | Retroperitoneale bloedingen (zoals retroperitoneaal hematoom) |
Niet bekend | Nausea, braken |
Huid- en onderhuidaandoeningen | |
Vaak | Ecchymose |
| Nier- en urinewegaandoeningen | |
Vaak | Urogenitale bloeding (zoals hematurie, urinewegbloeding) |
| Algemene aandoeningen en toedieningsplaatsstoornissen | |
Vaak | Injectieplaatsbloeding, bloeding op de plaats van een punctie |
| Onderzoeken | |
| Zelden | Bloeddruk verlaagd |
Niet bekend | Lichaamstemperatuur verhoogd |
| Letsels, intoxicaties en verrichtingencomplicaties | |
| Niet bekend | Vetembolie, wat kan leiden tot de bijbehorende gevolgen in de betrokken organen |
| Chirurgische en medische verrichtingen | |
| Niet bekend | Transfusie |
Tabel aangepast van Metalyse® SPC April 2024.
Frequentiegroepen worden gedefinieerd volgens de volgende conventie: zeer vaak (≥1/10), vaak (≥1/100 tot <1/10), zelden (≥1/10000 tot <1/1000), zeer zelden (<1/10000), niet bekend (kan niet worden geschat op basis van de beschikbare gegevens).
Voetnoten
-
*
Bij AIS werd tenecteplase binnen 4,5 uur na de laatst bekende normale toestand toegediend als een enkele bolus op basis van 0,25 mg/kg lichaamsgewicht: < 60 kg, 15 mg; ≥ 60 tot < 70 kg, 17,5 mg; ≥ 70 tot < 80 kg, 20 mg; ≥ 80 tot < 90 kg, 22,5 mg; en ≥ 90 kg, 25 mg tenecteplase.1
-
†
In de AcT fase 3 studie waren de percentages ongewenste bijwerkingen vergelijkbaar voor tenecteplase vergeleken met alteplase. De belangrijkste ongewenste voorvallen waren overlijden binnen 90 dagen (15,3% voor tenecteplase vs. 15,4% voor alteplase: RD -0,1 [95% CI -3,7 tot 3,5]), 24 uur symptomatische intracerebrale bloeding (3,4% vs. 3,2%: RD 0,2 [95% CI -1,5 tot 2,0], extracraniële bloeding (0,8% vs 0,8%: RD 0,0 [95% CI -0,9 tot 0,8]) en orolinguaal angio-oedeem (1,1% vs 1,2%; RD -0,1 [95% CI -1,1 tot 1,0]).1
-
‡
De geanalyseerde veiligheidseindpunten waren symptomatische intracerebrale bloeding (sICH) en mortaliteit. Symptomatische bloedingsincidenten in individuele onderzoeken werden bepaald op basis van de definitie van symptomatische intracerebrale bloeding die in elk onderzoek werd gebruikt. Voor mortaliteit en acute hersenbloeding werden de niet-inferioriteitsmarges vastgesteld op 1%.
-
AIS = acute ischemische beroerte; CI = betrouwbaarheidsinterval; RD = risicoverschil; sICH = symptomatische intracerebrale bloeding.
-
Referenties
-
Menon BK, et al. Lancet 2022; 400:161-169.
-
Burgos A. M. and Saver J. L. Stroke 2019; 50:2156-2162.
-
Metalyse® SPC April 2024.
